Comprender la masa molar de un compuesto como el nitrato de potasio es esencial para quienes estudian química o trabajan en campos relacionados con la ciencia y la ingeniería. El nitrato de potasio, comúnmente conocido como salitre, es un compuesto químico con una amplia gama de aplicaciones, desde fertilizantes hasta la conservación de alimentos. En este artículo, exploraremos el concepto de masa molar, cómo calcularla y su relevancia en el contexto del nitrato de potasio.
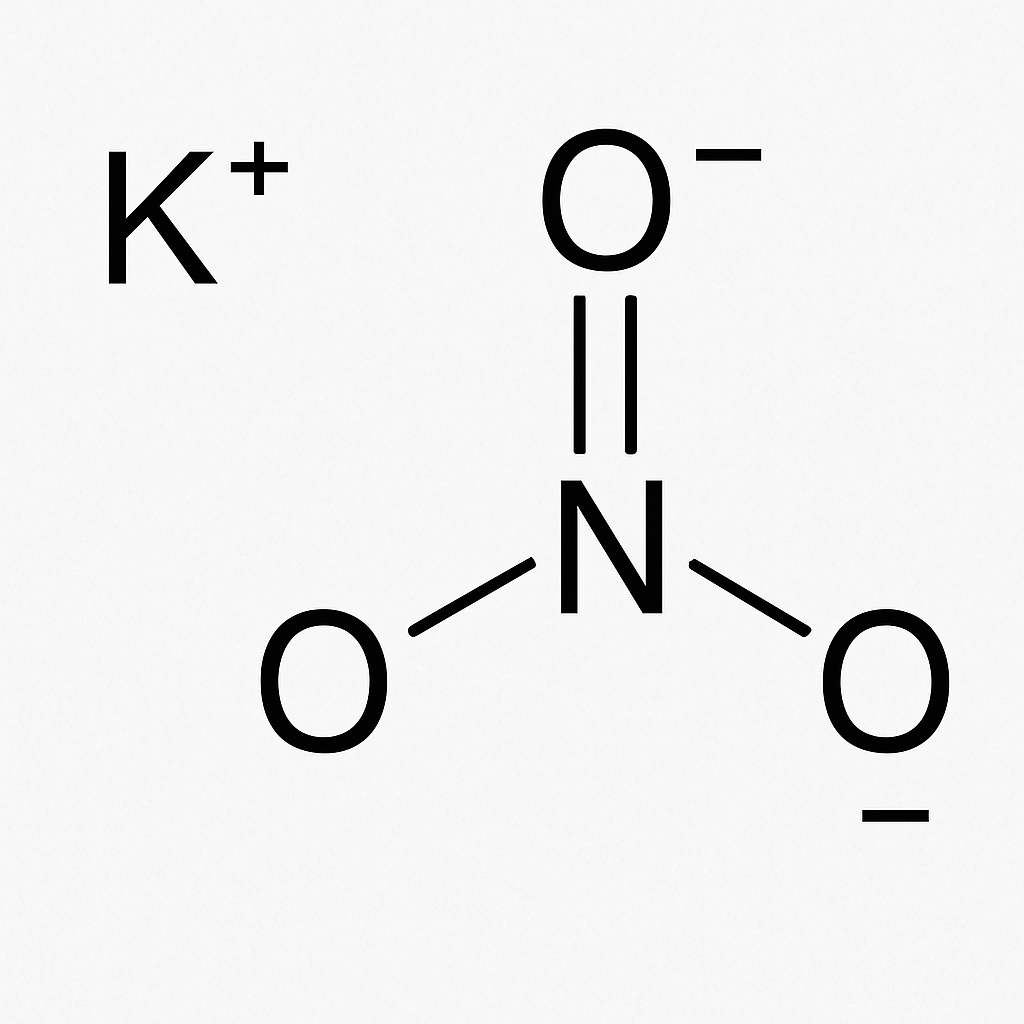
El nitrato de potasio (KNO₃) es un compuesto iónico compuesto de potasio (K), nitrógeno (N) y oxígeno (O). Es un sólido cristalino blanco a temperatura ambiente y altamente soluble en agua. Su fórmula química, KNO₃, indica que cada molécula está compuesta por un átomo de potasio, uno de nitrógeno y tres de oxígeno.
Usos del nitrato de potasio
El nitrato de potasio se utiliza ampliamente en diversas industrias. En la agricultura, sirve como fertilizante, aportando nutrientes esenciales para el crecimiento de las plantas. En la conservación de alimentos, se utiliza para curar carnes. Además, el nitrato de potasio es un ingrediente clave en la pólvora y los fuegos artificiales.
Entendiendo la masa molar
La masa molar es un concepto fundamental en química que se refiere a la masa de un mol de una sustancia. Un mol es una unidad de medida que representa 6,022 × 1023 Partículas, que pueden ser átomos, moléculas o iones. La masa molar permite a los químicos convertir la masa de una sustancia en moles.
Cómo calcular la masa molar
Para calcular la masa molar de un compuesto, es necesario conocer las masas atómicas de sus elementos constituyentes. Estas masas atómicas suelen encontrarse en la tabla periódica y se expresan en unidades de masa atómica (uma). Para nuestros fines, la masa atómica se expresará en gramos por mol (g/mol).
Cálculo paso a paso
- Identifique la fórmula química: Para el nitrato de potasio, la fórmula es KNO3.
- Encuentra las masas atómicas: Potasio (K): aproximadamente 39,10 g/mol, Nitrógeno (N): aproximadamente 14,01 g/mol, Oxígeno (O): aproximadamente 16,00 g/mol.
- Determinar el número de cada átomo: KNO3 contiene 1 átomo de potasio, 1 átomo de nitrógeno y 3 átomos de oxígeno.
- Calcular la masa molar total:Potasio: 1 x 39,10 = 39,10 g/molNitrógeno: 1 x 14,01 = 14,01 g/molOxígeno: 3 x 16,00 = 48,00 g/molMasa molar total = 39,10 + 14,01 + 48,00 = 101,11 g/mol
Por lo tanto, la masa molar de nitrato de potasio es 101,11 g/mol.
Importancia de la masa molar en química
Comprender la masa molar de un compuesto como el nitrato de potasio es crucial en muchos cálculos químicos. Permite a los científicos:
- Determinar la cantidad de sustancia necesaria para las reacciones.
- Calcular concentraciones en soluciones.
- Convertir entre gramos y moles en ecuaciones químicas.
Aplicaciones en reacciones químicas
En las reacciones químicas, conocer la masa molar ayuda a equilibrar ecuaciones y predecir la cantidad de reactivos y productos. Por ejemplo, al usar nitrato de potasio en una reacción, se puede calcular la cantidad necesaria para reaccionar completamente con otra sustancia.
Composición química del KNO3
El composición química del nitrato de potasio se puede descomponer en sus porcentajes elementales:
- Potasio (K): (39,10 / 101,11) x 100 ≈ 38,68%
- Nitrógeno (N): (14,01 / 101,11) x 100 ≈ 13,86%
- Oxígeno (O): (48,00 / 101,11) x 100 ≈ 47,46%
Estos porcentajes indican la proporción de cada elemento en el compuesto, lo cual es útil para comprender sus propiedades y comportamiento en diferentes condiciones.
Nitrato de potasio en el medio ambiente
El nitrato de potasio se encuentra de forma natural en yacimientos de todo el mundo. Participa en el ciclo del nitrógeno, un proceso crucial para mantener el equilibrio de los ecosistemas.
El nitrato de potasio en la vida cotidiana
Más allá de sus aplicaciones industriales, el nitrato de potasio se encuentra en productos cotidianos. En jardinería, se utiliza para aportar nutrientes esenciales a las plantas. En la alimentación, actúa como conservante, ayudando a mantener las carnes curadas seguras para el consumo.
Seguridad y manipulación
Mientras que el nitrato de potasio es generalmente seguro Para una correcta manipulación, es importante seguir las normas de seguridad. Debe almacenarse en un lugar fresco y seco, alejado de sustancias incompatibles, como ácidos fuertes. Se debe utilizar equipo de protección adecuado, como guantes y gafas protectoras, al manipularlo en el laboratorio.
Conclusión
Comprender la masa molar del nitrato de potasio es una habilidad esencial para cualquier persona interesada en la química. No solo ayuda a calcular las cantidades adecuadas para las reacciones químicas, sino que también proporciona información sobre las propiedades y aplicaciones del compuesto. Al dominar el concepto de masa molar, se puede apreciar mejor el papel del nitrato de potasio tanto en los procesos industriales como en la vida cotidiana.
En resumen, ya seas estudiante, profesional o simplemente tengas curiosidad por la química, comprender los fundamentos de la masa molar y su cálculo mejorará tu comprensión de este fascinante campo.