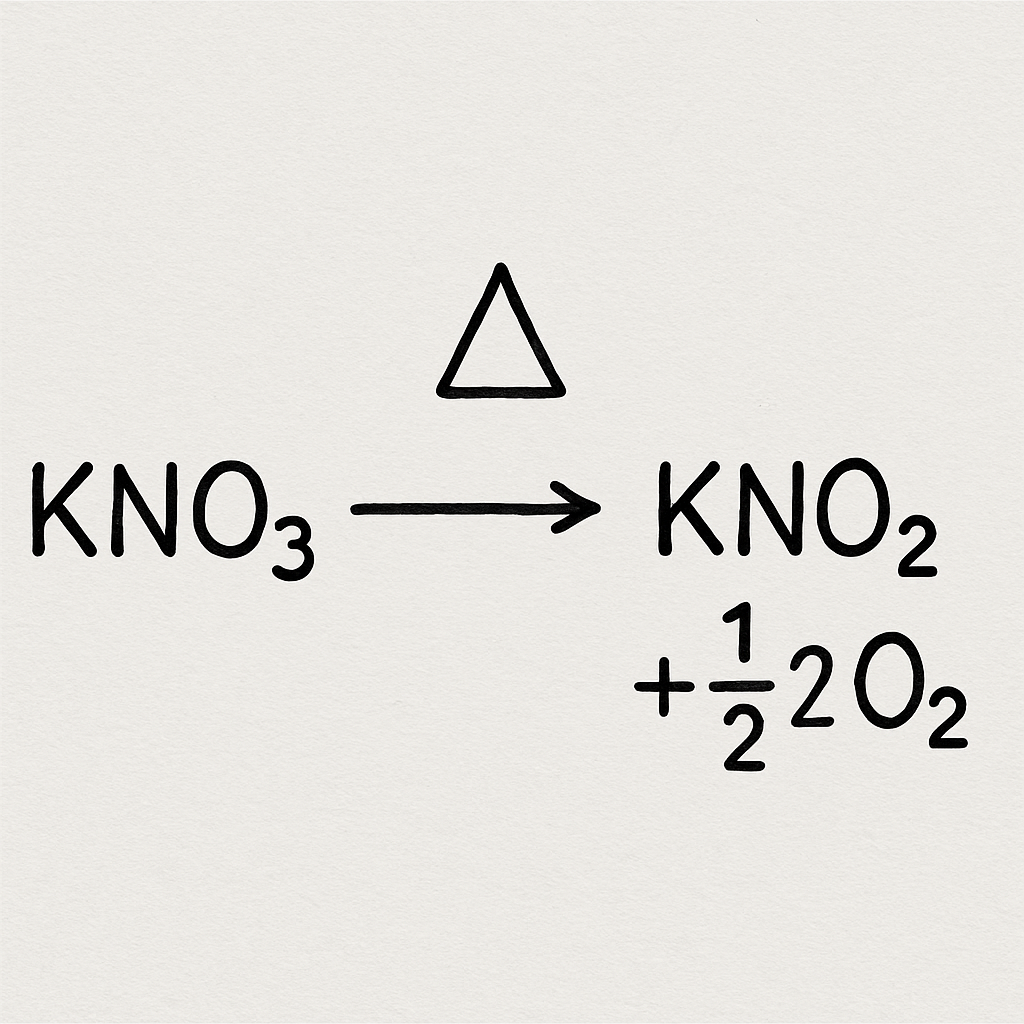El nitrato de potasio, comúnmente conocido como salitre, es un compuesto químico ampliamente utilizado en diversas industrias. Su fórmula química es KNO₃. Este compuesto es famoso no solo por su uso histórico en la pólvora, sino también por su papel en fertilizantes, conservación de alimentos e incluso en la pirotecnia. Las reacciones del nitrato de potasio pueden producir diversos productos interesantes, lo que lo convierte en un compuesto valioso en química.
El nitrato de potasio se compone de potasio (K), nitrógeno (N) y oxígeno (O). Es una sal cristalina y se presenta como un polvo blanco en su forma pura. solubilidad en agua y su capacidad de actuar como agente oxidante lo hacen particularmente útil en muchas reacciones químicas.
La química del KNO3
A nivel molecular, el nitrato de potasio se compone de un ion potasio (K+) y un ion nitrato (NO₃₃). El ion nitrato es poliatómico, es decir, contiene múltiples átomos. Este ion desempeña un papel fundamental en las diversas reacciones que involucran al nitrato de potasio.
Descomposición del nitrato de potasio
Una de las reacciones más intrigantes del nitrato de potasio es su descomposición. Al calentarse, se descompone en compuestos más simples. Esta descomposición es endotérmica, lo que significa que absorbe calor.
¿Qué sucede durante la descomposición?
La descomposición del nitrato de potasio se puede resumir mediante la siguiente ecuación química:
2KNO3→2KNO2+O2
En esta reacción, el nitrato de potasio se descompone en nitrito de potasio (KNO₂) y oxígeno gaseoso (O₂). Esta liberación de oxígeno es importante porque favorece la combustión, razón por la cual el nitrato de potasio se ha utilizado históricamente en la pólvora.
Reacciones de oxidación que involucran KNO3
El nitrato de potasio también es conocido por su papel en las reacciones de oxidación. Como agente oxidante, puede aceptar electrones de otras sustancias, lo que facilita diversas transformaciones químicas.
KNO3 como agente oxidante
En el contexto de las reacciones de oxidación, el nitrato de potasio se puede representar de forma simplificada de la siguiente manera:
2KNO3(s)+C(s)→2KNO2(s)+CO2(g)
En esta reacción, el nitrato de potasio oxida el carbono (C) a dióxido de carbono (CO₂), a la vez que se reduce a nitrito de potasio (KNO₂). Este tipo de reacción es fundamental en pirotecnia y otras aplicaciones que requieren una oxidación controlada.
Usos prácticos del nitrato de potasio
Más allá de sus propiedades químicas, el nitrato de potasio es un compuesto importante en diversas aplicaciones prácticas. Su capacidad para participar en reacciones químicas lo ha hecho valioso en diversos campos.
Fertilizantes y agricultura
En la agricultura, el nitrato de potasio se utiliza como fertilizante debido a su alto contenido de nitrógeno y potasio. Estos elementos son nutrientes esenciales para el crecimiento de las plantas. Proporciona una fuente fácilmente disponible de estos nutrientes., promoviendo el desarrollo saludable de las plantas.
Conservación de alimentos
El nitrato de potasio también contribuye a la conservación de alimentos. Se utiliza en el curado de carnes, donde ayuda a prevenir el crecimiento bacteriano y a mantener el color rosado de las mismas. Su uso está estrictamente regulado para garantizar la seguridad alimentaria.
Fuegos artificiales y pirotecnia
La naturaleza explosiva y reactiva del nitrato de potasio lo convierte en un componente clave en fuegos artificiales y pirotecnia. Su capacidad de liberar oxígeno durante la descomposición favorece la rápida combustión necesaria para crear exhibiciones vibrantes de luz y color.
Explorando más reacciones
La química del nitrato de potasio no se limita a la descomposición y la oxidación. Puede participar en otras reacciones que generan diferentes productos, según las condiciones y los reactivos involucrados.
Reacción con ácido sulfúrico
Cuando el nitrato de potasio reacciona con ácido sulfúrico concentrado (H2SO4), produce ácido nítrico (HNO3) y bisulfato de potasio (KHSO4):
KNO3+H2ENTONCES4→HNO3+KHSO4
Esta reacción se utiliza industrialmente para producir ácido nítrico, una sustancia química vital en los procesos de fabricación y de laboratorio.
Reacción con carbón vegetal
En los fuegos artificiales y la pólvora, el nitrato de potasio suele combinarse con carbón vegetal y azufre. Esta mezcla experimenta una rápida reacción exotérmica, produciendo gases que se expanden y provocan una explosión. La ecuación química balanceada para esta reacción en la pólvora es:
2KNO3+3C+S→K2S+3CO2+N2
Esto demuestra la versatilidad del nitrato de potasio en la creación de reacciones energéticas para aplicaciones prácticas.
Conclusión
El nitrato de potasio es un compuesto de gran importancia química y práctica. Su capacidad para descomponerse, oxidarse y participar en diversas reacciones lo convierte en un recurso valioso en múltiples industrias. Desde la agricultura hasta la pirotecnia, los productos de las reacciones del nitrato de potasio han determinado sus diversos usos. Comprender estas reacciones no solo resalta la versatilidad del KNO₃, sino que también subraya su papel en el avance de los procesos científicos e industriales. Ya sea en el laboratorio, en el campo o en el espacio aéreo, el nitrato de potasio sigue siendo un compuesto que merece la pena explorar.