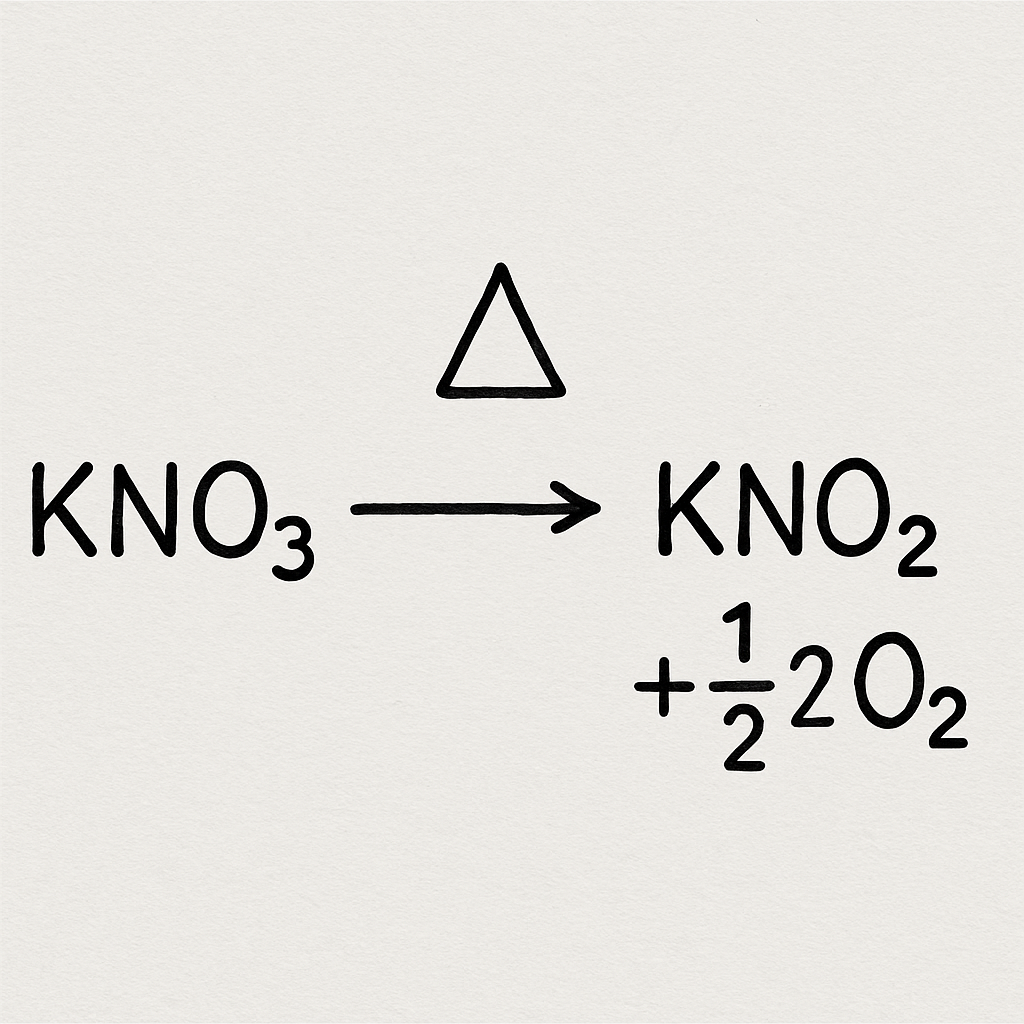Le nitrate de potassium, communément appelé salpêtre, est un composé chimique largement utilisé dans diverses industries. Sa formule chimique est KNO₃. Ce composé est célèbre non seulement pour son utilisation historique dans la poudre à canon, mais aussi pour son rôle dans les engrais, la conservation des aliments et même les feux d'artifice. Les réactions du nitrate de potassium peuvent produire une variété de produits intéressants, ce qui en fait un composé précieux en chimie.
Le nitrate de potassium est composé de potassium (K), d'azote (N) et d'oxygène (O). C'est un sel cristallin qui se présente sous forme de poudre blanche à l'état pur. solubilité dans l'eau et sa capacité à agir comme agent oxydant le rend particulièrement utile dans de nombreuses réactions chimiques.
La chimie du KNO3
Au niveau moléculaire, le nitrate de potassium est composé d'un ion potassium (K⁺) et d'un ion nitrate (NO₃⁻). L'ion nitrate est polyatomique, c'est-à-dire qu'il contient plusieurs atomes. Cet ion joue un rôle essentiel dans les différentes réactions impliquant le nitrate de potassium.
Décomposition du nitrate de potassium
L'une des réactions les plus intrigantes impliquant le nitrate de potassium est sa décomposition. Chauffé, le nitrate de potassium se décompose en composés plus simples. Cette décomposition est une réaction endothermique, c'est-à-dire qu'elle absorbe de la chaleur.
Que se passe-t-il lors de la décomposition ?
La décomposition du nitrate de potassium peut être résumée par l'équation chimique suivante :
2KNO3→2KNO2+O2
Au cours de cette réaction, le nitrate de potassium se décompose en nitrite de potassium (KNO2) et en dioxygène (O2). Ce dégagement d'oxygène est important car il favorise la combustion, raison pour laquelle le nitrate de potassium a été historiquement utilisé dans la poudre à canon.
Réactions d'oxydation impliquant KNO3
Le nitrate de potassium est également connu pour son rôle dans les réactions d'oxydation. En tant qu'agent oxydant, il peut accepter des électrons d'autres substances, facilitant ainsi diverses transformations chimiques.
Le KNO3 comme agent oxydant
Dans le contexte des réactions d'oxydation, le nitrate de potassium peut être représenté sous une forme simplifiée comme suit :
2KNO3(s)+C(s)→2KNO2(s)+CO2(g)
Dans cette réaction, le nitrate de potassium oxyde le carbone (C) en dioxyde de carbone (CO₂), tout en étant lui-même réduit en nitrite de potassium (KNO₂). Ce type de réaction est fondamental en pyrotechnie et dans d'autres applications nécessitant une oxydation contrôlée.
Utilisations pratiques du nitrate de potassium
Outre ses propriétés chimiques, le nitrate de potassium est un composé important dans diverses applications pratiques. Sa capacité à participer à des réactions chimiques le rend précieux dans plusieurs domaines.
Engrais et agriculture
En agriculture, le nitrate de potassium est utilisé comme engrais en raison de sa richesse en azote et en potassium. Ces éléments sont des nutriments essentiels à la croissance des plantes. fournit une source facilement disponible de ces nutriments, favorisant le développement sain des plantes.
Conservation des aliments
Le nitrate de potassium joue également un rôle dans la conservation des aliments. Il est utilisé dans le salaison des viandes, où il contribue à prévenir la prolifération bactérienne et à préserver leur couleur rose. Son utilisation est strictement réglementée afin de garantir la sécurité alimentaire.
Feux d'artifice et pyrotechnie
La nature explosive et réactive du nitrate de potassium en fait un composant clé des feux d'artifice et de la pyrotechnie. Sa capacité à libérer de l'oxygène lors de sa décomposition favorise la combustion rapide nécessaire à la création de jeux de lumière et de couleurs éclatants.
Exploration plus approfondie des réactions
La chimie du nitrate de potassium ne se limite pas à sa décomposition et à son oxydation. Il peut participer à d'autres réactions qui donnent des produits différents, selon les conditions et les réactifs impliqués.
Réaction avec l'acide sulfurique
Lorsque le nitrate de potassium réagit avec l'acide sulfurique concentré (H2SO4), il produit de l'acide nitrique (HNO3) et du bisulfate de potassium (KHSO4) :
KNO3+H2DONC4→HNO3+KHSO4
Cette réaction est utilisée industriellement pour produire de l'acide nitrique, un produit chimique essentiel dans les procédés de fabrication et de laboratoire.
Réaction avec le charbon de bois
Dans les feux d'artifice et la poudre à canon, le nitrate de potassium est souvent associé à du charbon de bois et du soufre. Ce mélange subit une réaction exothermique rapide, produisant des gaz qui se dilatent et provoquent une explosion. L'équation chimique équilibrée de cette réaction dans la poudre à canon est :
2KNO3+3C+S→K2S+3CO2+N2
Ceci illustre la polyvalence du nitrate de potassium dans la création de réactions énergétiques pour des applications pratiques.
Conclusion
Le nitrate de potassium est un composé d'une importance chimique et pratique considérable. Sa capacité à se décomposer, à s'oxyder et à participer à diverses réactions en fait une ressource précieuse pour de nombreux secteurs industriels. De l'agriculture à la pyrotechnie, les produits des réactions du nitrate de potassium ont façonné ses multiples usages. La compréhension de ces réactions met en lumière non seulement la polyvalence du KNO₃, mais aussi son rôle dans le progrès des procédés scientifiques et industriels. Que ce soit en laboratoire, sur le terrain ou même dans l'atmosphère, le nitrate de potassium demeure un composé qui mérite d'être exploré.